बैटरी कैसे काम करती है और काम करती है
 प्रौद्योगिकी में शब्द के व्यापक अर्थ में, "बैटरी" शब्द एक ऐसे उपकरण को संदर्भित करता है जो कुछ परिचालन स्थितियों के तहत एक निश्चित प्रकार की ऊर्जा जमा करने की अनुमति देता है, और दूसरों में इसे मानवीय जरूरतों के लिए उपयोग करने के लिए।
प्रौद्योगिकी में शब्द के व्यापक अर्थ में, "बैटरी" शब्द एक ऐसे उपकरण को संदर्भित करता है जो कुछ परिचालन स्थितियों के तहत एक निश्चित प्रकार की ऊर्जा जमा करने की अनुमति देता है, और दूसरों में इसे मानवीय जरूरतों के लिए उपयोग करने के लिए।
उनका उपयोग वहां किया जाता है जहां एक निश्चित समय के लिए ऊर्जा एकत्र करना आवश्यक होता है और फिर इसका उपयोग बड़ी श्रम-गहन प्रक्रियाओं को करने के लिए किया जाता है। उदाहरण के लिए, तालों में प्रयुक्त हाइड्रोलिक संचायक जहाजों को नदी के तल पर एक नए स्तर तक बढ़ने की अनुमति देते हैं।
इलेक्ट्रिक बैटरी एक ही सिद्धांत पर बिजली के साथ काम करती हैं: पहले, वे बाहरी चार्जिंग स्रोत से बिजली जमा (जमा) करते हैं और फिर इसे कनेक्टेड उपभोक्ताओं को काम करने के लिए देते हैं। अपने स्वभाव से, वे रासायनिक वर्तमान स्रोतों से संबंधित हैं जो बार-बार निर्वहन और आवेश के आवधिक चक्रों को पूरा करने में सक्षम हैं।
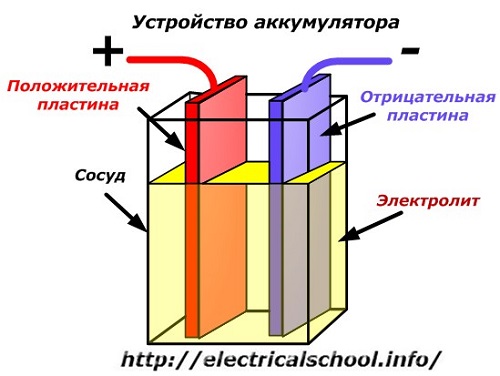
ऑपरेशन के दौरान, इलेक्ट्रोड प्लेटों के घटकों के बीच उनके भरने वाले पदार्थ - इलेक्ट्रोलाइट के साथ लगातार रासायनिक प्रतिक्रियाएं होती हैं।
एक बैटरी डिवाइस के एक योजनाबद्ध आरेख को सरलीकृत ड्राइंग द्वारा दर्शाया जा सकता है जब तारों के साथ विभिन्न धातुओं की दो प्लेटें विद्युत संपर्क प्रदान करने के लिए पोत के शरीर में डाली जाती हैं। प्लेटों के बीच एक इलेक्ट्रोलाइट डाला जाता है।
डिस्चार्ज होने पर बैटरी का संचालन
जब एक लोड, जैसे कि एक प्रकाश बल्ब, इलेक्ट्रोड से जुड़ा होता है, तो एक बंद विद्युत सर्किट बनाया जाता है जिसके माध्यम से डिस्चार्ज करंट प्रवाहित होता है। यह इलेक्ट्रोलाइट में धनायनों के साथ धातु भागों और आयनों में इलेक्ट्रॉनों की गति से बनता है।
यह प्रक्रिया परंपरागत रूप से निकल-कैडमियम इलेक्ट्रोड डिजाइन वाले आरेख पर दिखाई जाती है।
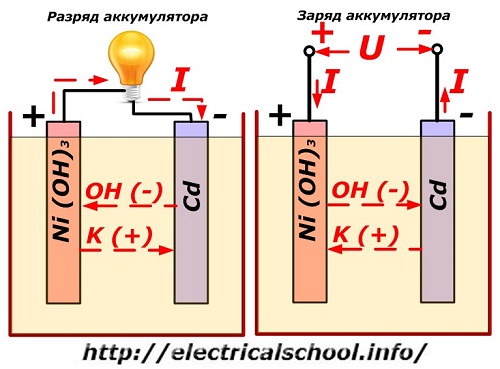
यहां, ग्रेफाइट एडिटिव्स के साथ निकल ऑक्साइड, जो विद्युत चालकता को बढ़ाते हैं, का उपयोग सकारात्मक इलेक्ट्रोड की सामग्री के रूप में किया जाता है। ऋणात्मक इलेक्ट्रोड की धातु स्पंजी कैडमियम है।
निर्वहन के दौरान, निकल ऑक्साइड से सक्रिय ऑक्सीजन कणों को इलेक्ट्रोलाइट में छोड़ दिया जाता है और नकारात्मक प्लेटों को निर्देशित किया जाता है, जहां कैडमियम ऑक्सीकृत होता है।
चार्ज करते समय बैटरी का प्रदर्शन
जब लोड बंद हो जाता है, तो एक स्थिर (कुछ स्थितियों में, स्पंदित) वोल्टेज उसी ध्रुवता की चार्ज बैटरी की तुलना में अधिक मूल्य के प्लेट टर्मिनलों पर लागू होता है, जब स्रोत और उपभोक्ता के प्लस और माइनस टर्मिनल मेल खाते हैं .
चार्जर में हमेशा अधिक शक्ति होती है, जो बैटरी में अवशिष्ट ऊर्जा को "दबा" देती है और निर्वहन की विपरीत दिशा में एक विद्युत प्रवाह बनाती है। नतीजतन, इलेक्ट्रोड और इलेक्ट्रोलाइट के बीच आंतरिक रासायनिक प्रक्रियाएं बदल जाती हैं। उदाहरण के लिए, निकल-कैडमियम प्लेटों के एक बॉक्स पर, सकारात्मक इलेक्ट्रोड ऑक्सीजन से समृद्ध होता है, और नकारात्मक - शुद्ध कैडमियम की स्थिति में।
जब बैटरी को डिस्चार्ज और चार्ज किया जाता है, तो प्लेट्स (इलेक्ट्रोड) की सामग्री की रासायनिक संरचना बदल जाती है, लेकिन इलेक्ट्रोलाइट नहीं बदलता है।
बैटरी कनेक्शन के तरीके
समानांतर कनेक्शन
किसी व्यक्ति द्वारा झेले जा सकने वाले डिस्चार्ज करंट की मात्रा कई कारकों पर निर्भर करती है, लेकिन मुख्य रूप से डिज़ाइन, उपयोग की गई सामग्री और उनके आयाम। इलेक्ट्रोड पर प्लेटों का क्षेत्र जितना बड़ा होगा, वे उतने ही अधिक करंट का सामना कर सकते हैं।
इस सिद्धांत का उपयोग बैटरी में समान प्रकार की कोशिकाओं को समानांतर में जोड़ने के लिए किया जाता है जब वर्तमान को लोड में बढ़ाने के लिए आवश्यक होता है। लेकिन इस तरह के डिजाइन को चार्ज करने के लिए, स्रोत की शक्ति को बढ़ाना आवश्यक होगा। इस विधि का उपयोग शायद ही कभी तैयार संरचनाओं के लिए किया जाता है, क्योंकि अब आवश्यक बैटरी को तुरंत खरीदना बहुत आसान है। लेकिन एसिड बैटरी निर्माता इसका इस्तेमाल करते हैं, अलग-अलग प्लेटों को सिंगल ब्लॉक में जोड़ते हैं।
सीरियल कनेक्शन
उपयोग की जाने वाली सामग्रियों के आधार पर, रोजमर्रा की जिंदगी में आम बैटरी की दो इलेक्ट्रोड प्लेटों के बीच 1.2 / 1.5 या 2.0 वोल्ट का वोल्टेज उत्पन्न किया जा सकता है। (वास्तव में, यह सीमा बहुत व्यापक है।) जाहिर है, यह कई विद्युत उपकरणों के लिए पर्याप्त नहीं है। इसलिए, एक ही प्रकार की बैटरी श्रृंखला में जुड़ी हुई हैं, और यह अक्सर एक मामले में किया जाता है।
इस तरह के डिजाइन का एक उदाहरण सल्फ्यूरिक एसिड और लीड इलेक्ट्रोड प्लेट्स पर आधारित व्यापक ऑटोमोटिव विकास है।
आमतौर पर, लोगों के बीच, विशेष रूप से परिवहन चालकों के बीच, किसी भी उपकरण को बैटरी कहा जाता है, चाहे उसके घटक तत्वों की संख्या कितनी भी हो - बक्से। हालाँकि, यह पूरी तरह से सही नहीं है।श्रृंखला में जुड़े कई बक्सों से इकट्ठा की गई संरचना पहले से ही एक बैटरी है, जिसके लिए संक्षिप्त नाम «एकेबी» चिपका है... इसकी आंतरिक संरचना को चित्र में दिखाया गया है।
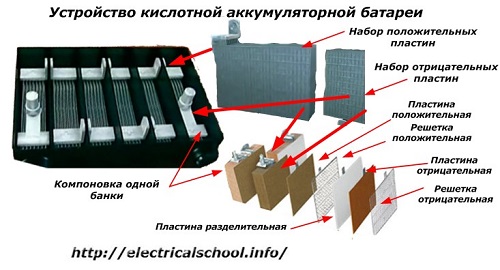
प्रत्येक जार में सकारात्मक और नकारात्मक इलेक्ट्रोड के लिए प्लेटों के एक सेट के साथ दो ब्लॉक होते हैं। इलेक्ट्रोलाइट के माध्यम से एक विश्वसनीय गैल्वेनिक कनेक्शन की संभावना के साथ धातु के संपर्क के बिना ब्लॉक एक दूसरे में फिट होते हैं।
इस मामले में, संपर्क प्लेटों में एक अतिरिक्त ग्रिड होता है और एक विभाजक प्लेट द्वारा एक दूसरे से अलग किया जाता है।
प्लेटों को ब्लॉकों में जोड़ने से उनका कार्य क्षेत्र बढ़ जाता है, संपूर्ण संरचना का कुल प्रतिरोध कम हो जाता है और आपको कनेक्टेड लोड की शक्ति बढ़ाने की अनुमति मिलती है।
बॉक्स के बाहर, ऐसी बैटरी में नीचे दिए गए चित्र में दिखाए गए तत्व होते हैं।
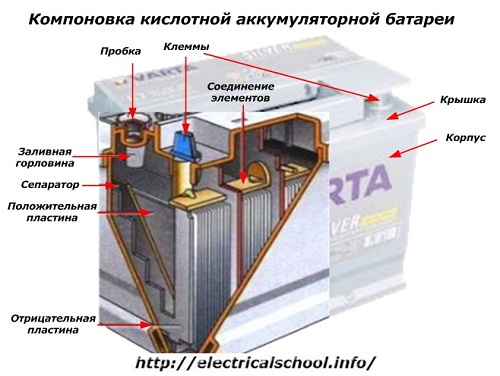
यह दिखाता है कि मजबूत प्लास्टिक हाउसिंग को एक कवर के साथ सील कर दिया गया है और कार के इलेक्ट्रिकल सर्किट के कनेक्शन के लिए शीर्ष पर दो टर्मिनलों (आमतौर पर शंकु के आकार का) से लैस किया गया है। ध्रुवता चिह्न उनके टर्मिनलों पर अंकित होते हैं: «+» और «-«। आमतौर पर पॉजिटिव टर्मिनल में वायरिंग एरर को ब्लॉक करने के लिए नेगेटिव टर्मिनल की तुलना में थोड़ा बड़ा व्यास होता है।
उपयोग में लाई जाने वाली बैटरियों में इलेक्ट्रोलाइट स्तर को नियंत्रित करने या ऑपरेशन के दौरान आसुत जल जोड़ने के लिए प्रत्येक जार के शीर्ष पर एक भराव छेद होता है। इसमें एक प्लग खराब हो जाता है, जो मामले की आंतरिक गुहाओं को संदूषण से बचाता है और साथ ही बैटरी को झुकाए जाने पर इलेक्ट्रोलाइट को फैलने से रोकता है।
चूंकि एक शक्तिशाली चार्ज के साथ, इलेक्ट्रोलाइट से गैसिंग संभव है (और गहन ड्राइविंग के दौरान यह प्रक्रिया संभव है), बॉक्स के अंदर दबाव को बढ़ने से रोकने के लिए प्लग में छेद किए जाते हैं।ऑक्सीजन और हाइड्रोजन, साथ ही इलेक्ट्रोलाइट वाष्प उनके माध्यम से बाहर निकलते हैं। अत्यधिक चार्जिंग धाराओं वाली ऐसी स्थितियों से बचने की अनुशंसा की जाती है।
वही आंकड़ा बैंकों के बीच तत्वों के कनेक्शन और इलेक्ट्रोड प्लेटों की व्यवस्था को दर्शाता है।
कार स्टार्टर बैटरी (लेड एसिड) डबल सल्फेशन के सिद्धांत पर काम करती है। डिस्चार्ज / चार्जिंग के दौरान, इलेक्ट्रोलाइट (सल्फ्यूरिक एसिड) में पानी की रिहाई / अवशोषण के साथ इलेक्ट्रोड के सक्रिय द्रव्यमान की रासायनिक संरचना में बदलाव के साथ, उन पर एक विद्युत रासायनिक प्रक्रिया होती है।
यह चार्ज करते समय इलेक्ट्रोलाइट के विशिष्ट गुरुत्व में वृद्धि और बैटरी के डिस्चार्ज होने पर घटने की व्याख्या करता है। दूसरे शब्दों में, घनत्व मान आपको बैटरी की विद्युत स्थिति का आकलन करने की अनुमति देता है। इसे मापने के लिए एक विशेष उपकरण का उपयोग किया जाता है - एक कार हाइड्रोमीटर।
आसुत जल, जो एसिड बैटरी के इलेक्ट्रोलाइट का हिस्सा है, एक ठोस अवस्था में बदल जाता है - नकारात्मक तापमान पर बर्फ। इसलिए, ठंड के मौसम में कार की बैटरी को जमने से रोकने के लिए, नियमों में दिए गए विशेष उपायों को लागू करना आवश्यक है शोषण के लिए।
बैटरी कितने प्रकार की होती हैं?
विभिन्न प्रयोजनों के लिए आधुनिक उत्पादन इलेक्ट्रोड और इलेक्ट्रोलाइट की विभिन्न संरचना के साथ तीन दर्जन से अधिक उत्पादों का उत्पादन करता है। 12 ज्ञात मॉडल केवल लिथियम पर चलते हैं।

निम्नलिखित को इलेक्ट्रोड धातु के रूप में पाया जा सकता है:
-
नेतृत्व करना;
-
लोहा;
-
लिथियम;
-
टाइटेनियम;
-
कोबाल्ट;
-
कैडमियम;
-
निकल;
-
जस्ता;
-
चाँदी;
-
वैनेडियम;
-
अल्युमीनियम
-
कुछ अन्य वस्तुएँ।
वे विद्युत उत्पादन विशेषताओं और इसलिए अनुप्रयोग को प्रभावित करते हैं।
इलेक्ट्रिक स्टार्टर मोटर्स द्वारा आंतरिक दहन इंजनों के क्रैंकशाफ्ट के रोटेशन के परिणामस्वरूप अल्पकालिक उच्च भार का सामना करने की क्षमता सीसा-एसिड बैटरी की विशेषता है। वे व्यापक रूप से परिवहन, निर्बाध बिजली आपूर्ति और आपातकालीन बिजली प्रणालियों में उपयोग किए जाते हैं।
मानक गैल्वेनिक कोशिकाएं (नियमित बैटरी) आमतौर पर निकल-कैडमियम, निकल-जस्ता और निकल-धातु हाइड्राइड बैटरी द्वारा प्रतिस्थापित की जाती हैं।
लेकिन लिथियम-आयन या लिथियम-पॉलीमर डिजाइन मोबाइल और कंप्यूटिंग डिवाइस, निर्माण उपकरण और यहां तक कि इलेक्ट्रिक वाहनों में भी विश्वसनीय रूप से काम करते हैं।
प्रयुक्त इलेक्ट्रोलाइट के प्रकार के अनुसार, बैटरी हैं:
-
खट्टा
-
क्षारीय।
उद्देश्य के अनुसार बैटरियों का वर्गीकरण है। उदाहरण के लिए, आधुनिक परिस्थितियों में, ऐसे उपकरण दिखाई दिए हैं जिनका उपयोग ऊर्जा हस्तांतरण के लिए किया जाता है - अन्य स्रोतों को रिचार्ज करना। वैकल्पिक विद्युत नेटवर्क की अनुपस्थिति में तथाकथित बाहरी बैटरी कई मोबाइल उपकरणों के मालिकों की मदद करती है। यह टैबलेट, स्मार्टफोन, मोबाइल फोन को बार-बार चार्ज करने में सक्षम है।
इन सभी बैटरियों के संचालन का एक ही सिद्धांत और एक समान उपकरण है। उदाहरण के लिए, नीचे दिए गए चित्र में दिखाया गया लिथियम-आयन फिंगर मॉडल कई तरह से पहले चर्चा की गई एसिड बैटरी के डिज़ाइन को दोहराता है।
यहां हम समान संपर्क इलेक्ट्रोड, प्लेट, विभाजक और आवास देखते हैं। केवल उन्हें अन्य कार्य स्थितियों को ध्यान में रखते हुए बनाया गया है।
बैटरी की बुनियादी विद्युत विशेषताएं
डिवाइस का संचालन मापदंडों से प्रभावित होता है:
-
क्षमता;
-
ऊर्जा घनत्व;
-
स्व निर्वहन;
-
तापमान शासन।
क्षमता को बैटरी का अधिकतम चार्ज कहा जाता है, जिसे वह सबसे कम वोल्टेज के डिस्चार्ज के दौरान देने में सक्षम होता है। इसे पेंडेंट (SI सिस्टम) और एम्पीयर-घंटे (नॉन-सिस्टम यूनिट) में व्यक्त किया जाता है।
एक प्रकार की क्षमता के रूप में "ऊर्जा क्षमता" होती है, जो न्यूनतम स्वीकार्य वोल्टेज के निर्वहन के दौरान जारी ऊर्जा को निर्धारित करती है। इसे जूल (एसआई) और वाट-घंटे (गैर-एसआई इकाइयों) में मापा जाता है।
ऊर्जा घनत्व बैटरी के भार या आयतन के लिए ऊर्जा की मात्रा के अनुपात के रूप में व्यक्त किया जाता है।
स्व-निर्वहन टर्मिनलों पर भार के अभाव में चार्ज करने के बाद क्षमता के नुकसान पर विचार करता है। यह डिजाइन पर निर्भर करता है और कई कारणों से इलेक्ट्रोड के बीच इन्सुलेशन टूटने से खराब हो जाता है।
ऑपरेटिंग तापमान विद्युत गुणों को प्रभावित करता है और निर्माता द्वारा निर्दिष्ट मानदंड से गंभीर विचलन के मामले में, यह बैटरी को नुकसान पहुंचा सकता है। गर्मी और ठंड अस्वीकार्य हैं, वे रासायनिक प्रतिक्रियाओं और बॉक्स के अंदर पर्यावरण के दबाव को प्रभावित करते हैं।
